A qPCR kísérletekben a primer tervezés is nagyon fontos láncszem.Az, hogy a primerek alkalmasak-e vagy sem, szorosan összefügg azzal, hogy az amplifikációs hatásfok eléri-e a standardot, az amplifikált termékek specifikusak-e, és rendelkezésre állnak-e a kísérleti eredmények.
Tehát hogyan lehet jobbá tenni a qPCR primer specifitását?Magas erősítési hatásfok?
Ma elvezetjük Önt arra, hogy közösen tervezzen qPCR primereket, és hagyja, hogy a qPCR primer tervezése a kísérletek hatékony tudásává váljon.
A qPCR primerek tervezésénél általában a következő szempontokra kell figyelni: a primereket lehetőleg intronokra kell tervezni, a termék hossza 100-300 bp legyen, a Tm érték a lehető legközelebb legyen a 60°C-hoz, az upstream és downstream primerek a lehető legközelebb legyenek, a primer vége pedig G vagy C legyen.
1. Intronokon átívelő primerek tervezése
A qPCR primerek tervezése során az intronokra tervezett primerek kiválasztása megakadályozhatja a gDNS-templát amplifikációját, és a termékek mind a cDNS amplifikációjából származnak, így kiküszöbölhető a gDNS-szennyeződés hatása.
2. Alapozó hossza
A primer hossza általában 18-30 nt között van, és az amplifikációs termék hosszát 100-300 bp között kell szabályozni, amennyire csak lehetséges.
Ha a primer túl rövid, az nem specifikus erősítéshez vezet, ha pedig túl hosszú, akkor könnyen másodlagos struktúrát (például hajtűszerkezetet) képez.Ha az amplifikációs termék túl hosszú, akkor nem alkalmas a polimeráz reakciójára, ami befolyásolja a PCR amplifikáció hatékonyságát.
3. GC-tartalom és Tm-érték
A primerek GC-tartalmát 40% és 60% között kell szabályozni.Ha túl magas vagy túl alacsony, az nem kedvez a reakció beindításának.A forward és a reverse primerek GC-tartalmának közel azonosnak kell lennie ahhoz, hogy azonos Tm-értéket és hőkezelési hőmérsékletet kapjunk.
A Tm értéknek lehetőleg 55-65°C között kell lennie, általában 60°C körül, és a folyásirányban felfelé és lefelé a Tm értéknek a lehető legközelebb kell lennie, lehetőleg legfeljebb 4°C.
4. Kerülje az A-t az alapozó 3′ végén
Ha a primer 3′ vége nem illeszkedik, nagy különbségek vannak a különböző bázisok szintézis hatékonyságában.Ha az utolsó bázis A, láncszintézist is indíthat még hibás illeszkedés esetén is, ha pedig az utolsó bázis T When , akkor az illesztési indukció hatékonysága nagymértékben csökken.Ezért próbálja meg elkerülni az A-t az alapozó 3′ végén, és jobb a T-t választani.
Ha szonda primerről van szó, akkor a szonda 5′ vége nem lehet G, mert még ha egyetlen G bázis is kapcsolódik a FAM fluoreszcens riporter csoporthoz, a G is képes kioltani a FAM csoport által kibocsátott fluoreszcens jelet, ami hamis negatív eredményt eredményez.Megjelenik.
5. Alapeloszlás
A négy bázis eloszlása a primerben lehetőleg véletlenszerű, elkerülve, hogy a 3' végén több mint 3 egymást követő G vagy C, és több mint 3 egymást követőG vagy C könnyen létrehozható párosítás a GC-ben gazdag szekvencia régióban.
6. A primer tervezési régiójának kerülnie kell a bonyolult másodlagos struktúrákat.
Az amplifikációs termék egyetlen szála által alkotott másodlagos szerkezet befolyásolja a PCR zökkenőmentes lefolyását.Ha előre megjósolja, hogy van-e másodlagos struktúra a célszekvenciában, próbálja meg elkerülni ezt a régiót a primerek tervezésénél.
7. Maguknak a primereknek és a primerek között meg kell próbálniuk elkerülni az egymást követő komplementer bázisokat.
Maga a primer és a primer között nem lehet egymást követő 4 bázisos komplementaritás.Maga a primer nem tartalmazhat komplementer szekvenciát, különben összehajtja magát, és hajtűszerkezetet alkot, ami befolyásolja a primer és a templát hőkezelési kombinációját.
Komplementer szekvenciák nem létezhetnek az upstream és downstream primerek között.A primerek közötti komplementaritás primer dimereket eredményez, ami csökkenti a PCR hatékonyságát, és még a mennyiségi pontosságot is befolyásolja.Ha a primer-dimer és a hajtűszerkezetek elkerülhetetlenek, a △G érték nem lehet túl magas (kevesebb, mint 4,5 kcal/mol).
8. A primerek felerősítik a célspecifikus terméket.
A qPCR kimutatás végső célja a célgén bőségességének megértése.Ha nem specifikus erősítés történik, a kvantifikáció pontatlan lesz.Ezért a primerek tervezése után a BLAST-tel tesztelni kell őket, és a termékek specifitását összehasonlítani kell a szekvencia adatbázisban.
Ezután a humán GAS6 (Growth Arrest specific 6) gént vesszük példaként a qPCR primerek tervezésére.
01 lekérdezési gén
Homo GAS6az NCBI-n keresztül.Itt figyelnünk kell a génnév és a faj összehasonlítására, hogy biztosítsuk a konzisztenciát.
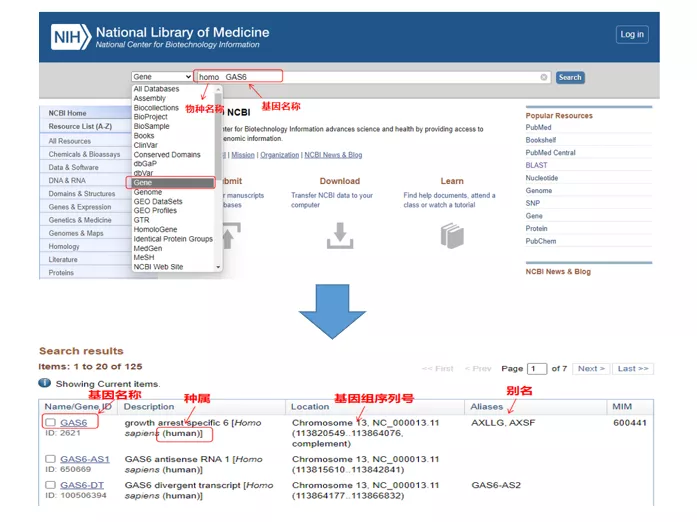 02 Keresse meg a génszekvenciát
02 Keresse meg a génszekvenciát
(1) Ha a célszekvencia genomiális DNS, válassza ki az elsőt, amely a gén genomiális DNS-szekvenciája.
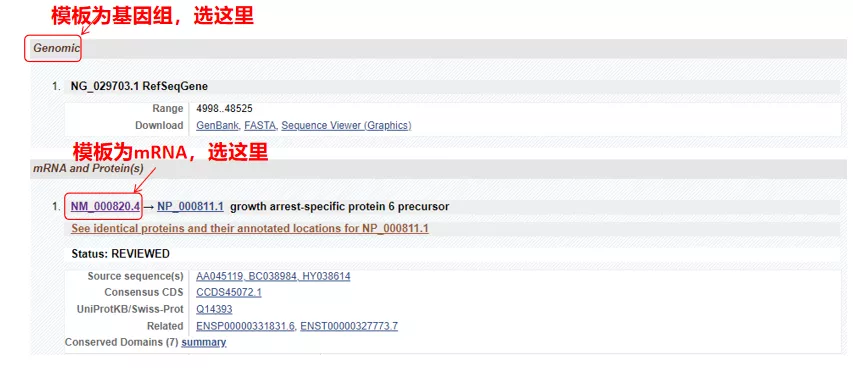 (2) Ha a célszekvencia mRNS, válassza ki a másodikat.A belépés után kattintson a „CDS” gombra az alábbi táblázatban.A barna háttérszekvencia a gén kódoló szekvenciája.
(2) Ha a célszekvencia mRNS, válassza ki a másodikat.A belépés után kattintson a „CDS” gombra az alábbi táblázatban.A barna háttérszekvencia a gén kódoló szekvenciája.
 03 Tervező alapozók
03 Tervező alapozók
Lépjen be a Primer-BLAST interfészbe
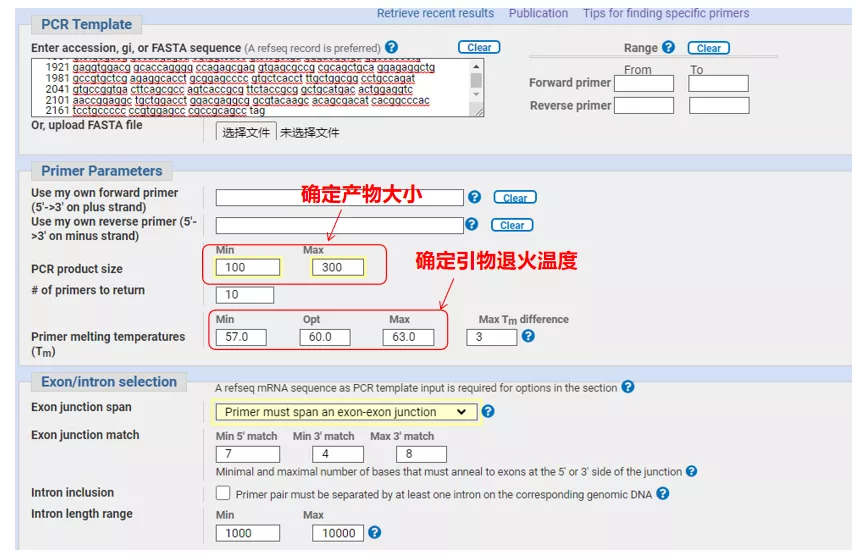
 Írja be a gén sorszámát vagy a szekvenciát Fasta formátumban a bal felső sarokban, és adja meg a megfelelő paramétereket.
Írja be a gén sorszámát vagy a szekvenciát Fasta formátumban a bal felső sarokban, és adja meg a megfelelő paramétereket.
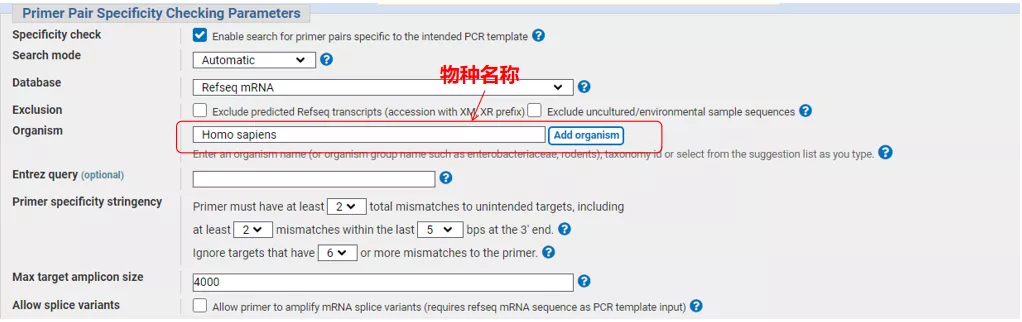
Kattintson a „Get primers” (Primerek beszerzése) gombra, és az NCBI felugrik, jelezve, hogy az ilyen paraméterek kiválasztása más illesztési változatokra is kiterjed.Ellenőrizhetjük a különböző illesztési változatokat, és beküldhetjük a megfelelő alapozópárt (az alábbi ábrán látható módon).Ez a folyamat több tíz másodpercig is eltarthat.
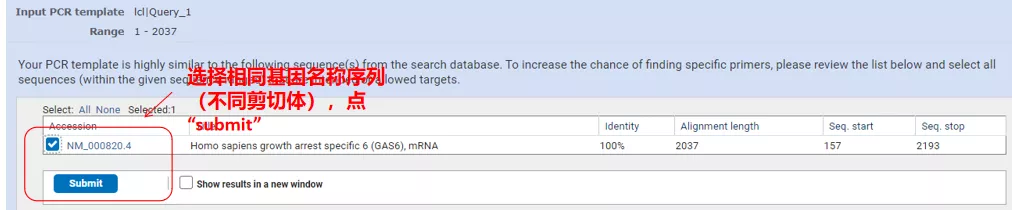
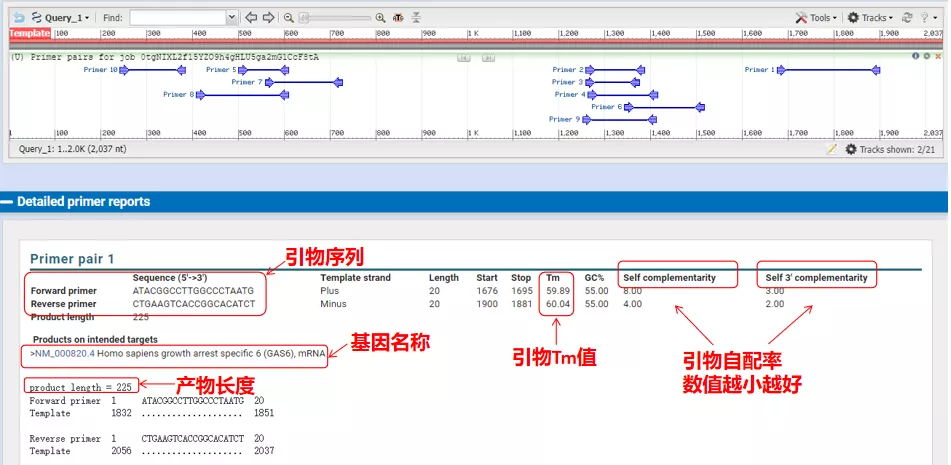 Ezeknek az alapozópároknak a hőkezelési hőmérséklete 60°C körül van.A kísérlet céljának megfelelően válasszon közepes hosszúságú, jó specificitású és a primerek kevésbé önkomplementáló primereket a kísérlethez, és a sikerességi arány meglehetősen magas!
Ezeknek az alapozópároknak a hőkezelési hőmérséklete 60°C körül van.A kísérlet céljának megfelelően válasszon közepes hosszúságú, jó specificitású és a primerek kevésbé önkomplementáló primereket a kísérlethez, és a sikerességi arány meglehetősen magas!
04A primer specifitásának ellenőrzése
Valójában az alapozók tervezése mellett a Primer-Blast az általunk tervezett alapozókat is ki tudja értékelni.Térjen vissza a primer tervezési oldalára, adja meg az általunk tervezett upstream és downstream primereket, és a többi paraméter nem lesz módosítva.A beküldés után láthatja, hogy a primerpár más géneken is létezik-e.Ha ezek mindegyike megjelenik az amplifikálni kívánt génen, ami azt jelzi, hogy ennek a primerpárnak a specifitása nagyszerű!(Például ez a primer lekérdezés egyetlen eredménye!)
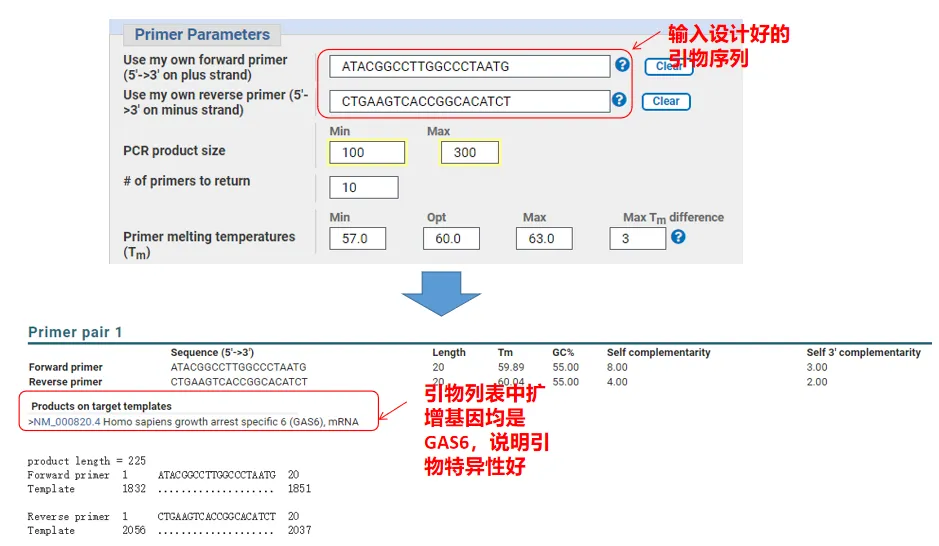
05 Primer minőségi megítélés
Milyen primer az a „tökéletes” primer, amely egyesíti a „szabványos amplifikációs hatékonyságot”, az „erősített termékjellemzőket” és a „megbízható kísérleti eredményeket”?
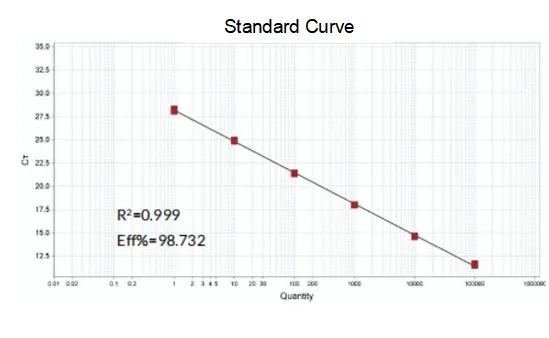 Erősítés hatékonysága
Erősítés hatékonysága
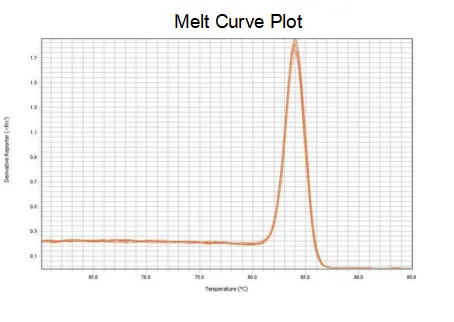 olvadási görbe
olvadási görbe
A primerek amplifikációs hatékonysága eléri a 90%-110%-ot, ami azt jelenti, hogy az amplifikációs hatásfok jó, az olvadási görbe pedig egyetlen csúcsú, és általában Tm>80°C, ami azt jelenti, hogy az amplifikációs specificitás jó.
Kapcsolódó termékek:
Valós idejű PCR Easy – SYBR GREEN I
Valós idejű PCR Easy-Taqman
Feladás időpontja: 2023.02.10








