Laboratóriumi újdonságként nem jó feladat kiszűrni a pozitív növényeket egy csokor alacsony konverziós arányú növényből.Először nagyszámú mintából kell egyenként kivonni a DNS-t, majd PCR-rel kimutatják az idegen géneket.Az eredmények azonban gyakran üresek és esetenként néhány elemet tartalmazó sávok, de nem lehet megállapítani, hogy vannak-e kimaradt vagy téves észlelések..Nagyon tehetetlen egy ilyen kísérleti folyamattal és eredménnyel szembenézni?Ne aggódj, a testvér megtanít arra, hogyan lehet egyszerűen és pontosan kiszűrni a transzgénikus pozitív növényeket.
1. lépés
Detektáló primerek tervezése
Határozza meg a kimutatandó endogén és exogén gént a vizsgálandó minta alapján, és válasszon egy reprezentatív 100-500 bp szekvenciát a génben a primer tervezéshez.A jó primerek biztosíthatják a detektálási eredmények pontosságát és lerövidíthetik a detektálási időt (lásd a mellékletet az általánosan használt detektáló primerekről).
Megjegyzés: Az újonnan tervezett primereknek optimalizálniuk kell a reakciókörülményeket, és ellenőrizniük kell a detektálás pontosságát, pontosságát és kimutatási határát a nagy léptékű detektálás előtt.
2. lépés
Tervezési kísérleti protokoll
Pozitív kontroll: A célfragmenst tartalmazó tisztított DNS-t használja templátként annak meghatározására, hogy a PCR reakciórendszer és a körülmények normálisak-e.
Negatív/vak kontroll: Használja a célfragmenst nem tartalmazó DNS-templátot vagy ddH2O-t templátként annak kimutatására, hogy van-e szennyeződés forrása a PCR-rendszerben.
Belső referenciakontroll: használja a vizsgálandó minta endogén génjének primer/próba kombinációját annak értékelésére, hogy a templát PCR-rel kimutatható-e.
Értesítés:
Minden vizsgálathoz pozitív, negatív/vak kontrollokat és belső kontrollokat kell beállítani a kísérleti eredmények érvényességének értékelése érdekében.
Kísérleti előkészítés
Használat előtt ellenőrizze, hogy az oldat egyenletesen elkeveredett-e.Ha csapadékot észlel, azt felhasználás előtt fel kell oldani és össze kell keverni az utasításoknak megfelelően.A 2×PCR keveréket használat előtt pipettázni és mikropipettával többször össze kell keverni, hogy elkerüljük az egyenetlen ioneloszlást.
Értesítés:
Vegye ki a kézikönyvet és figyelmesen olvassa el, és a kísérlet előtt a kézikönyv előírásainak szigorú betartásával készüljön el.
4. lépés
Készítse elő a PCR reakciórendszert
A kísérleti protokoll szerint a primereket, a H2O-t és a 2×PCR-keveréket egyenletesen keverjük össze, centrifugáljuk és osszuk szét mindegyik reakciócsőben.
Értesítés:
Nagy léptékű vagy hosszú távú vizsgálatokhoz UNG enzimet tartalmazó PCR reakciórendszer alkalmazása javasolt, amellyel hatékonyan elkerülhető a PCR termékek okozta aeroszol szennyeződés.
5. lépés
Adjon hozzá reakciósablont
A Direct PCR technológia segítségével nincs szükség fárasztó nukleinsav tisztítási folyamatra, a minta templát 10 percen belül elkészíthető, és hozzáadható a megfelelő PCR reakciórendszer.
Értesítés:
A hasítási módszer jobb kimutatási hatású, és a kapott termék többszörös kimutatási reakcióra is felhasználható.
5.1: A levelek közvetlen kitágulása
A kézikönyvben található kép méretének megfelelően vágja le a 2-3 mm átmérőjű levélszövetet és helyezze a PCR reakciórendszerbe.
Megjegyzés: Győződjön meg arról, hogy a levéltöredékek teljesen elmerülnek a PCR reakcióoldatban, és ne adjon hozzá túlzott mennyiségű levélszövetet.
5.2: Levélhasítási módszer
Vágja le az 5-7 mm átmérőjű levélszövetet, és helyezze egy centrifugacsőbe.Ha érett leveleket választ, kérjük, kerülje a levél főérének szöveteinek használatát.Pipettázzunk 50 ul puffer P1 lizátumot egy centrifugacsőbe annak biztosítására, hogy a lizátum teljesen elmerítse a levélszövetet, helyezze hőciklusba vagy fémfürdőbe, és lizálja 95 °C-on 5-10 percig.
Adjon hozzá 50 ul puffer P2 semlegesítő oldatot, és jól keverje össze.A kapott lizátum templátként használható, és hozzáadható a PCR reakciórendszerhez.
Megjegyzés: A templát mennyisége a PCR-rendszer 5-10%-a között van, és nem haladhatja meg a 20%-ot (például egy 20μl-es PCR rendszerben adjon hozzá 1-2μl lízisoldatot, legfeljebb 4μl-t).
6. lépés
PCR reakció
A PCR reakciócsövet centrifugálás után PCR-műszerbe helyezzük amplifikáció céljából.
Értesítés:
A reakció nem tisztított templátot használ az amplifikációhoz, így az amplifikációs ciklusok száma 5-10 ciklussal több, mint a tisztított DNS-templát használatakor.
7. lépés
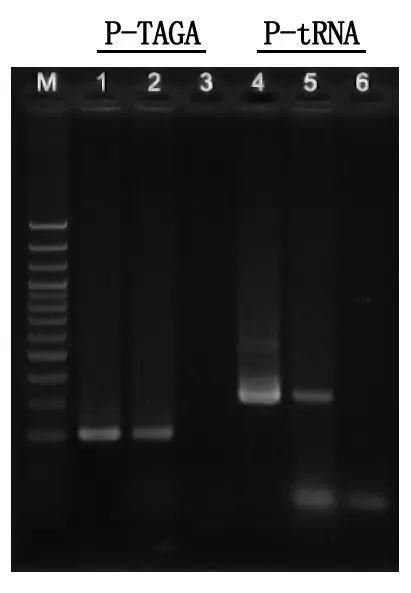
Elektroforézis kimutatás és eredményelemzés
M: 100 bp DNS-létra
1\4: Tisztított DNS módszer
2\5: Közvetlen PCR módszer
3\6: Üres vezérlő
QC:
A kísérletben beállított különböző kontrollok vizsgálati eredményeinek a következő feltételeknek kell megfelelniük.Ellenkező esetben elemezni kell a probléma okát, és a probléma elhárítása után újra el kell végezni a tesztet.
1. táblázat: A különböző kontrollcsoportok normál vizsgálati eredményei
*Ha a plazmidot pozitív kontrollként használják, az endogén génteszt eredménye negatív lehet
Eredményi ítélet:
V. A minta endogén génjének vizsgálati eredménye negatív, ami azt jelzi, hogy a szokásos PCR kimutatásra alkalmas DNS nem kinyerhető a mintából, vagy a kivont DNS PCR-reakciót gátló anyagokat tartalmaz, és a DNS-t ismételten ki kell vonni.
B. A minta endogén génjének vizsgálati eredménye pozitív, az exogén géné negatív, ami arra utal, hogy a mintából szokványos PCR kimutatásra alkalmas DNS-t vonnak ki, és megállapítható, hogy a XXX gén nem mutatható ki a mintában.
C. A minta endogén génjének vizsgálati eredménye pozitív, az exogén géné pozitív, ami azt jelzi, hogy a mintából a szokásos PCR kimutatásra alkalmas DNS-t kinyertük, és a minta DNS tartalmazza a XXX gént.A megerősítő kísérletek tovább végezhetők.
8. lépés
Detektáló primerek tervezése
A kísérlet után 2%-os nátrium-hipoklorit oldattal és 70%-os etanol oldattal törölje le a kísérleti területet a környezetszennyezés elkerülése érdekében.
Feladás időpontja: 2021.08.08