A molekuláris biológiai technológia folyamatos fejlődésével a génmutációk és a hibák, betegségek kapcsolata egyre mélyebb megértést nyert.A nukleinsavak nagy figyelmet keltettek a betegségek diagnosztizálásában és kezelésében való nagy alkalmazási lehetőségük miatt.A nukleinsav gyógyszerek mesterségesen szintetizált DNS- vagy RNS-fragmensekre utalnak, amelyek betegségkezelési funkciót töltenek be.Az ilyen gyógyszerek közvetlenül hatnak a betegséget okozó célgénekre vagy a betegséget okozó cél-mRNS-ekre, és szerepet játszhatnak a betegségek génszintű kezelésében.A hagyományos kis molekulájú gyógyszerekkel és antitest gyógyszerekkel összevetve a nukleinsav gyógyszerek képesek a gyökértől kezdve szabályozni a betegséget okozó gének expresszióját, és olyan jellemzőkkel bírnak, mint „a tünetek kezelése és a kiváltó ok gyógyítása”.A nukleinsav gyógyszereknek nyilvánvaló előnyei is vannak, például nagy hatékonyság, alacsony toxicitás és nagy specifitás.A fomivirsen-nátrium első nukleinsav gyógyszerének 1998-as bevezetése óta számos nukleinsav gyógyszert engedélyeztek klinikai kezelésre.
A jelenleg világszerte forgalomban lévő nukleinsav gyógyszerek elsősorban az antiszensz nukleinsavat (ASO), a kis interferáló RNS-t (siRNS) és a nukleinsav aptamereket tartalmazzák.A nukleinsav-aptamerek kivételével (amelyek meghaladhatják a 30 nukleotidot) a nukleinsav gyógyszerek általában 12-30 nukleotidból álló oligonukleotidok, más néven oligonukleotid gyógyszerek.Emellett a miRNS-ek, ribozimek és dezoxiribozimek is nagy fejlesztői értéket mutattak különböző betegségek kezelésében.A nukleinsav gyógyszerek napjaink egyik legígéretesebb területévé váltak a biomedicina kutatásában és fejlesztésében.
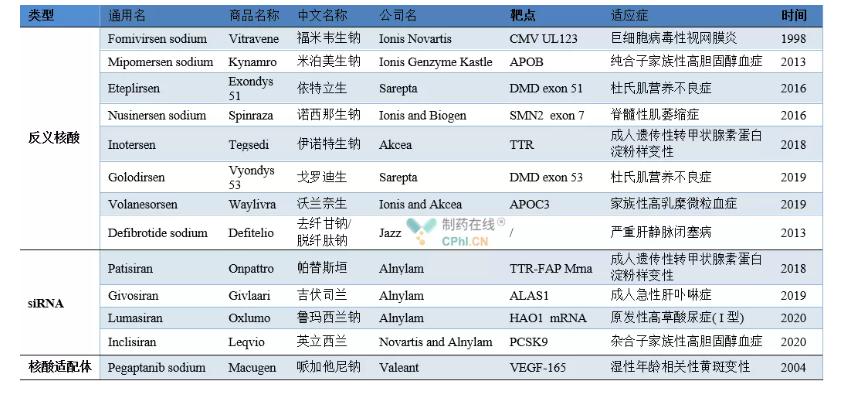
Példák jóváhagyott nukleinsav gyógyszerekre
Antiszensz nukleinsav
Az antiszensz technológia a Watson-Crick báziskomplementáció elvén alapuló új gyógyszerfejlesztési technológia, amely a szervezet által mesterségesen szintetizált vagy szintetizált specifikus komplementer DNS- vagy RNS-fragmenseket használ a célgének expressziójának specifikus szabályozására.Az antiszensz nukleinsav bázisszekvenciája komplementer a cél-RNS-sel, és specifikusan kötődni tud hozzá.Az antiszensz nukleinsavak általában magukban foglalják az antiszensz DNS-t, az antiszensz RNS-t és a ribozimeket.Ezek közül az antiszensz DNS nagy stabilitása és alacsony költsége miatt az antiszensz DNS domináns helyet foglal el az antiszensz nukleinsav gyógyszerek jelenlegi kutatásában és alkalmazásában.
A Fomivirsen-nátriumot (kereskedelmi név Vitravene) az Ionis Novartis fejlesztette ki.1998 augusztusában az FDA jóváhagyta a citomegalovírus retinitis kezelésére immunhiányos betegeknél (főleg AIDS-betegeknél), így ez lett az első forgalomba hozott nukleinsav gyógyszer.A fomivirsen gátolja a CMV részleges fehérjeexpresszióját azáltal, hogy specifikus mRNS-hez (IE2) kötődik, ezáltal szabályozza a virális gének expresszióját a terápiás hatás elérése érdekében.A nagy hatékonyságú antiretrovirális terápia megjelenése miatt azonban, amely nagymértékben csökkentette a betegek számát, 2002-ben és 2006-ban a Novartis visszavonta a Fomivirsen-gyógyszerek forgalomba hozatali engedélyét Európában, illetve az Egyesült Államokban, és a készítményt felfüggesztették a forgalomból.
A Mipomersen-nátrium (Kynamro kereskedelmi név) a francia Genzyme cég által kifejlesztett ASO gyógyszer.2013 januárjában az FDA jóváhagyta a homozigóta családi hiperkoleszterinémia kezelésére.A mipomersen az ApoB-100 mRNS-hez kötődve gátolja az ApoB-100 fehérje (apolipoprotein) expresszióját, ezáltal jelentősen csökkenti a humán alacsony sűrűségű lipoprotein koleszterin, alacsony sűrűségű lipoprotein és egyéb indikátorokat, de mellékhatások miatt, mint például a májtoxicitás, 2012. december 13. Ugyanezen a napon az EMA-t is forgalomba hozták.
2016 szeptemberében az FDA jóváhagyta a Sarepta által a Duchenne-féle izomdisztrófia (DMD) kezelésére kifejlesztett Eteplirsen-t (kereskedelmi név Exon 51).A DMD-betegek normális esetben nem tudnak funkcionális anti-atrófiás fehérjét kifejezni a DMD gén mutációi miatt a szervezetben.Az eteplirsen specifikusan kötődik a fehérje pre-mesenger RNS-ének (Pre-mRNS) 51-es exonjához, eltávolítja az 51-es exont, és visszaállít néhány downstream gént. A normál expresszió, transzkripció és transzláció a disztrofin egy részének kinyerése érdekében a terápiás hatás elérése érdekében.
A Nusinersen a Spinraza által a spinális izomsorvadás kezelésére kifejlesztett ASO gyógyszer, amelyet az FDA 2016. december 23-án hagyott jóvá. 2018-ban az FDA jóváhagyta a Tegsedi által a felnőttkori örökletes transztiretin amiloidózis kezelésére kifejlesztett Inotesent.2019-ben a Sarepta által a Duchenne-i izomdisztrófia kezelésére kifejlesztett Golodirsent jóváhagyta az FDA.Hatásmechanizmusa megegyezik az Eteplirsennel, és a hatás helye az 53-as exon lesz. Ugyanebben az évben az Ionisand Akcea által közösen kifejlesztett, a családi hyperchylomicronemia kezelésére kifejlesztett Volanessorsent jóváhagyta az Európai Gyógyszerügynökség (EMA).A voláneszorzen szabályozza a triglicerid metabolizmust az apolipoprotein C-Ⅲ termelésének gátlásával, de mellékhatása a vérlemezkeszint csökkentése is.
A defibrotid egy plazmin tulajdonságokkal rendelkező oligonukleotid keverék, amelyet a Jazz fejlesztett ki.90%-ban egyszálú DNS-t és 10%-ban kétszálú DNS-t tartalmaz.Az EMA 2013-ban hagyta jóvá, majd az FDA jóváhagyta a súlyos májvénák kezelésére.Elzáródásos betegség.A defibrotid növelheti a plazmin aktivitását, növelheti a plazminogén aktivátort, elősegítheti a trombomodulin felszabályozását, valamint csökkentheti a von Willebrand faktor és a plazminogén aktivátor inhibitorok expresszióját a terápiás hatások elérése érdekében
siRNS
Az siRNS egy kis RNS-fragmens, amelynek meghatározott hosszúsága és szekvenciája a cél-RNS levágásával keletkezik.Ezek az siRNS-ek specifikusan indukálhatják a cél-mRNS lebomlását, és géncsendesítő hatást érhetnek el.A kémiai kis molekulájú gyógyszerekkel összehasonlítva az siRNS-gyógyszerek géncsendesítő hatása magas specificitással és hatékonysággal rendelkezik.
2018. augusztus 11-én az FDA jóváhagyta és hivatalosan is piacra dobta az első siRNS gyógyszert, a patisiran-t (kereskedelmi név Onpattro).Ez az egyik legfontosabb mérföldkő az RNS-interferencia technológia fejlődéstörténetében.A Patisirant az Alnylam és a Genzyme, a Sanofi leányvállalata közösen fejlesztette ki.Ez egy siRNS gyógyszer az örökletes tiroxin által közvetített amiloidózis kezelésére.2019-ben a givosiránt (Givlaari kereskedelmi név) az FDA a második siRNS-gyógyszerként hagyta jóvá az akut májporfíria kezelésére felnőtteknél.2020-ban az Alnylam elsődleges I. típusú gyógyszert fejlesztett ki gyermekek és felnőttek kezelésére.Az FDA jóváhagyta a magas oxaluriatartalmú lumasirant.2020 decemberében a Novartis és az Alnylam által a felnőttkori hiperkoleszterinémia vagy vegyes diszlipidémia kezelésére közösen kifejlesztett Inclisiran-t jóváhagyta az EMA.
Aptamer
A nukleinsav-aptamerek olyan oligonukleotidok, amelyek nagy affinitással és specifitással képesek kötődni számos célmolekulához, például kis szerves molekulákhoz, DNS-hez, RNS-hez, polipeptidekhez vagy fehérjékhez.Az antitestekhez képest a nukleinsav-aptamerek egyszerű szintézissel, alacsonyabb költséggel és széles célponttal rendelkeznek, és szélesebb potenciállal rendelkeznek a betegségek diagnosztizálásában, kezelésében és megelőzésében.
A pegaptanib az első nukleinsav aptamer gyógyszer, amelyet a Valeant fejlesztett ki nedves időskori makuladegeneráció kezelésére, és amelyet az FDA 2004-ben hagyott jóvá. Ezt követően 2006 januárjában és 2008 júliusában az EMA és a PMDA jóváhagyta, és piacra került.A pegaptanib gátolja az angiogenezist a térszerkezet és a vaszkuláris endoteliális növekedési faktor kombinációján keresztül a terápiás hatás elérése érdekében.Azóta a Lucentis hasonló gyógyszerek versenytársával találkozott, piaci részesedése pedig sokat esett.
A nukleinsav gyógyszerek figyelemreméltó gyógyító hatásuk és rövid fejlesztési ciklusuk miatt a klinikai gyógyszer- és új gyógyszerpiac forró pontjává váltak.Feltörekvő kábítószerként kihívásokkal és lehetőségekkel néz szembe.Exogén tulajdonságainak köszönhetően a nukleinsavak specificitása, stabilitása és hatékony szállítása vált a fő kritériumok közé annak megítélésében, hogy az oligonukleotidok igen hatékony nukleinsav hatóanyagokká válhatnak-e.A célon kívüli hatások mindig is kulcsfontosságúak voltak a nukleinsav gyógyszerekben, amelyeket nem lehet figyelmen kívül hagyni.A nukleinsav gyógyszerek azonban a gyökértől kezdve befolyásolhatják a betegséget okozó gének expresszióját, és egybázisú szinten szekvencia-specifitást érhetnek el, ami a „kiváltó ok kezelése és a tünetek kezelése” jellemzői.Tekintettel az egyre több betegség változékonyságára, csak a genetikai kezeléssel lehet tartós eredményt elérni.A kapcsolódó technológiák folyamatos fejlesztésével, tökéletesedésével és fejlődésével az antiszensz nukleinsavak, siRNS és nukleinsav aptamerek által képviselt nukleinsav gyógyszerek minden bizonnyal új hullámot indítanak el a betegségkezelésben és a gyógyszeriparban.
Rreferenciák:
[1] Liu Shaojin, Feng Xuejiao, Wang Junshu, Xiao Zhengqiang, Cheng Pingsheng.A nukleinsav gyógyszerek piacelemzése hazámban és ellenintézkedések[J].Chinese Journal of Biological Engineering, 2021, 41(07): 99-109.
[2] Chen Wenfei, Wu Fuhua, Zhang Zhirong, Sun Xun.Kutatási előrehaladás a forgalomba hozott nukleinsav gyógyszerek farmakológiájában[J].Chinese Journal of Pharmaceuticals, 2020, 51(12): 1487-1496.
[3] Wang Jun, Wang Lan, Lu Jiazhen, Huang Zhen.A forgalomba hozott nukleinsav gyógyszerek hatékonyságának és kutatási előrehaladásának elemzése[J].Chinese Journal of New Drugs, 2019, 28(18): 2217-2224.
A szerzőről: Sha Luo, a kínai orvoslás kutató-fejlesztő munkatársa jelenleg egy nagy hazai gyógyszerkutató és -fejlesztő cégnél dolgozik, és elkötelezett az új kínai gyógyszerek kutatása és fejlesztése iránt.
Kapcsolódó termékek:
Feladás időpontja: 2021.11.19